En matière de tumeurs cérébrales, les termes gliome et glioblastome sont souvent utilisés indifféremment, bien qu'ils désignent des affections aux comportements et aux pronostics très différents. Ces deux tumeurs se développent à partir des cellules gliales, qui soutiennent et protègent les cellules nerveuses du cerveau. Cependant, le glioblastome représente la forme la plus agressive et la plus mortelle parmi les gliomes, et son diagnostic a des implications thérapeutiques et pronostiques très différentes.
Il est essentiel de bien distinguer le gliome du glioblastome pour un diagnostic précis, la planification du traitement, l'évaluation du pronostic et le conseil aux patients. Le type et le grade de la tumeur influencent sa vitesse de croissance, son traitement et les résultats que les patients et leurs familles peuvent raisonnablement espérer.
Ce blog explique la différence entre le gliome et le glioblastome de manière claire, structurée et fondée sur des preuves. Il s'appuie sur des données cliniques, des données de survie et des recommandations de traitement provenant de centres de cancérologie de référence.
Gliome vs. Glioblastome : Exploration des notions de base
Qu'est-ce qu'un gliome ?
Les tumeurs cérébrales sont généralement classées selon le type de cellules dont elles sont issues, car cela détermine leur comportement et leur traitement. Parmi ces catégories, les gliomes constituent l'un des groupes les plus importants et les plus fréquemment diagnostiqués de tumeurs cérébrales primitives chez l'adulte. Ils se développent dans le cerveau ou la moelle épinière et représentent une part significative des tumeurs du système nerveux central observées en pratique clinique.
Le terme « gliome » désigne de manière générale les tumeurs issues des cellules gliales, cellules de soutien essentielles au bon fonctionnement du cerveau. Les cellules gliales étant présentes dans tout le cerveau et la moelle épinière, les gliomes peuvent se développer à différents endroits et affecter un large éventail de fonctions neurologiques. Il est important de noter que les gliomes ne constituent pas une entité pathologique unique. Ils représentent un groupe hétérogène de tumeurs qui diffèrent par leur origine cellulaire, leur comportement biologique et leur évolution clinique.
Les gliomes présentent une grande variabilité quant à leur vitesse de croissance, leur agressivité et leur réponse au traitement. Certains gliomes évoluent lentement et peuvent rester stables pendant des années avec des symptômes minimes, tandis que d'autres se développent rapidement et envahissent les tissus cérébraux environnants. Cette grande variabilité implique que les approches thérapeutiques et les résultats peuvent différer considérablement d'un patient à l'autre. Le grade tumoral, les caractéristiques moléculaires et la localisation dans le cerveau sont autant de facteurs déterminants pour établir le pronostic et orienter les décisions cliniques.
Obtenez un devis gratuit
Types de gliomes
Les gliomes sont classés en fonction du type de cellules gliales auquel ils ressemblent le plus à l'examen microscopique. Cette classification aide les médecins à comprendre le comportement probable de la tumeur et à déterminer les traitements les plus efficaces.
1. Astrocytomes :
Les astrocytomes se développent à partir des astrocytes, cellules gliales en forme d'étoile qui soutiennent les neurones et contribuent à réguler l'environnement chimique du cerveau. Ces tumeurs sont le type de gliome le plus fréquent et peuvent survenir à tout âge. Les astrocytomes présentent un large éventail de formes, allant de tumeurs de bas grade à croissance lente à des formes très agressives. Le glioblastome est un astrocytome de grade 4, représentant la forme la plus sévère de cette catégorie.
2. Oligodendrogliomes :
Les oligodendrogliomes se développent à partir des oligodendrocytes, cellules gliales responsables de la production de myéline, la gaine protectrice des fibres nerveuses. Ces tumeurs ont tendance à croître plus lentement que les astrocytomes et sont souvent associées à une meilleure réponse au traitement et à une survie plus longue.
3. Épendymomes :
Les épendymomes se développent à partir des cellules épendymaires, qui tapissent les ventricules cérébraux et le canal central de la moelle épinière. Ces tumeurs peuvent toucher aussi bien les enfants que les adultes et perturber la circulation normale du liquide céphalo-rachidien, entraînant une augmentation de la pression intracrânienne. Leur évolution varie selon leur localisation et leur stade.
Cette classification cellulaire fournit une base pour comprendre les différences biologiques entre les gliomes et explique pourquoi le traitement et le pronostic peuvent varier considérablement d'un patient à l'autre.
Grades des gliomes
Selon l'Organisation mondiale de la santé (QUI), les gliomes sont classés en fonction du degré d'anomalie des cellules tumorales observées au microscope.
| Classements de l'OMS | Comportement tumoral | Caractères clés | Implications cliniques |
| Niveau 1 | Croissance lente | Souvent bien délimitées, non invasives et quasi bénignes | Souvent traité par chirurgie seule ; la survie à long terme est fréquente |
| Niveau 2 | Infiltrant de bas grade | Croissance lente mais se propage dans les tissus cérébraux voisins | Nécessite une surveillance à long terme du risque de progression vers des grades supérieurs |
| Niveau 3 | Maligne et à croissance rapide | Cellules anormales à division rapide | Nécessite un traitement combiné de chirurgie, de radiothérapie et de chimiothérapie. |
| Niveau 4 | Très malin | Croissance rapide, invasion tissulaire et zones de nécrose | Le glioblastome relève exclusivement du grade 4 et nécessite un traitement agressif |
Qu'est-ce qu'un glioblastome ?
Le glioblastome, également appelé glioblastome multiforme, est la tumeur cérébrale primitive la plus agressive et la plus mortelle chez l'adulte. Il représente une part importante des tumeurs cérébrales malignes diagnostiquées dans le monde et se caractérise par sa progression rapide et son pronostic sombre. Contrairement à de nombreuses autres tumeurs cérébrales, le glioblastome se développe rapidement et envahit les tissus cérébraux environnants, rendant son ablation chirurgicale complète extrêmement difficile. Le glioblastome ne constitue pas une catégorie de maladie distincte, mais plutôt la forme la plus agressive au sein du spectre des astrocytomes.
Il est classé comme un gliome astrocytaire de grade 4 selon la classification de l'OMS des tumeurs cérébrales. Cette classification reflète sa nature hautement maligne, caractérisée par une croissance cellulaire incontrôlée, une invasion étendue des structures cérébrales voisines et des zones de nécrose tumorale dues à une vascularisation insuffisante. L'une des caractéristiques déterminantes du glioblastome est sa résistance au traitement. Même avec une thérapie agressive comprenant chirurgie, radiothérapie et chimiothérapie, la tumeur récidive fréquemment. Sa capacité à infiltrer le tissu cérébral sain à un niveau microscopique permet aux cellules cancéreuses de persister après le traitement, contribuant ainsi aux taux élevés de récidive. Ces caractéristiques biologiques font du glioblastome l'une des tumeurs cérébrales les plus difficiles à prendre en charge en pratique clinique et soulignent la nécessité de poursuivre les recherches sur des thérapies plus efficaces.
Caractéristiques biologiques du glioblastome
Le glioblastome se caractérise par plusieurs particularités biologiques distinctes qui expliquent son comportement agressif et sa faible réponse au traitement.
- Division cellulaire rapideLes cellules du glioblastome se divisent à un rythme très élevé, ce qui entraîne une croissance tumorale rapide et une aggravation rapide des symptômes. Cette prolifération rapide permet à la tumeur d'augmenter de volume en peu de temps, provoquant souvent une détérioration neurologique soudaine.
- Zones de nécroseLorsque la tumeur se développe plus vite que sa vascularisation ne le permet, certaines parties se retrouvent privées d'oxygène et de nutriments. Il en résulte des zones de nécrose, ou tissu mort, caractéristique du glioblastome, visibles en imagerie et en histologie. La nécrose est l'une des principales raisons pour lesquelles le glioblastome est classé comme une tumeur de grade 4.
- Formation étendue de vaisseaux sanguinsLes glioblastomes stimulent la formation de nouveaux vaisseaux sanguins, un processus appelé angiogenèse. Ces vaisseaux anormaux alimentent la tumeur en nutriments et favorisent sa croissance rapide. Cependant, leur structure est souvent déficiente, ce qui contribue à l'œdème et aux fuites dans les tissus cérébraux environnants.
- Infiltration dans le tissu cérébral environnantContrairement aux tumeurs qui se développent sous forme d'une masse unique, les cellules du glioblastome se propagent au niveau microscopique dans les tissus cérébraux sains avoisinants. Ce mode de croissance infiltrant rend l'exérèse chirurgicale complète quasi impossible et constitue une cause majeure de récidive tumorale après traitement.
Ensemble, ces caractéristiques expliquent pourquoi le glioblastome se comporte de manière plus agressive que les autres gliomes et pourquoi il nécessite des approches thérapeutiques intensives et multimodales.
Gliome vs Glioblastome : Tableau des principales différences
| Fonctionnalité | Gliome | Glioblastome |
| Définition | Groupe de tumeurs issues de cellules gliales | Gliome de grade 4 le plus agressif |
| Grade de la tumeur | De la 1e à la 4e année | Toujours en 4e année |
| Vitesse de croissance | Lent à rapide | Très rapide |
| Envahissement | Peut-être localisé | Infiltration élevée |
| ablation chirurgicale | Souvent possible dans les classes inférieures | Rarement complet |
| Risque de récidive | Cela dépend du niveau | Très élevé |
| Survie médiane | Des années dans les tumeurs de bas grade | 12-15 mois |
| Traitement standard | Chirurgie +/- radiothérapie +/- chimiothérapie | Chirurgie + radiothérapie + chimiothérapie |
| Pronostic | Large gamme, souvent des notes basses favorables | Mauvais dans l'ensemble |
Le terme « gliome » désigne plusieurs types de tumeurs cérébrales présentant des grades, des vitesses de croissance et des pronostics variés. Certains gliomes évoluent lentement et peuvent souvent être pris en charge efficacement, notamment lorsqu'ils sont de bas grade. À l'inverse, le glioblastome représente la forme la plus agressive de gliome. Il s'agit toujours d'une tumeur de grade 4, à croissance très rapide, qui envahit les tissus cérébraux environnants, présente un risque élevé de récidive et nécessite un traitement intensif et combiné. De ce fait, le pronostic du glioblastome est nettement plus sombre que celui de la plupart des autres gliomes.
Symptômes du gliome et du glioblastome : signes similaires, vitesse d’évolution différente
Les symptômes du gliome et du glioblastome varient selon la localisation de la tumeur dans le cerveau, sa taille et sa vitesse de croissance. Différentes régions du cerveau contrôlant différentes fonctions, même de petites tumeurs peuvent provoquer des symptômes notables si elles affectent des zones vitales. En général, ces deux affections partagent de nombreux symptômes, mais la vitesse d'apparition et d'aggravation de ces symptômes diffère souvent.
Symptômes communs aux deux affections
- Maux de tête persistants
- Saisies
- Faiblesse d'un côté du corps
- changements de la parole ou de la vision
- Les problèmes de mémoire
Différence dans l'évolution des symptômes
- Gliome : Les symptômes se développent souvent progressivement et peuvent s'aggraver lentement sur plusieurs mois, voire plusieurs années, notamment dans le cas des tumeurs de bas grade. Les patients peuvent initialement ignorer des changements subtils, ce qui retarde le diagnostic.
- Glioblastome: Les symptômes ont tendance à progresser rapidement, parfois en quelques semaines. Une détérioration neurologique soudaine, des maux de tête intenses ou l'apparition de crises d'épilepsie sont fréquentes et nécessitent souvent une consultation médicale urgente.
Cette progression rapide des symptômes est une caractéristique clinique clé du glioblastome et conduit fréquemment à un diagnostic plus précoce, même si la maladie est déjà à un stade avancé au moment de sa détection.
Diagnostic : Comment les médecins différencient un gliome d'un glioblastome
La distinction entre un gliome et un glioblastome est une étape cruciale pour planifier le traitement approprié et comprendre l'évolution probable de la maladie. Les médecins suivent un processus diagnostique structuré et progressif qui combine imagerie avancée, examen tissulaire et tests moléculaires. Chaque étape apporte des précisions importantes sur l'agressivité de la tumeur et sur la stratégie thérapeutique à adopter.
1. Imagerie cérébrale (IRM avec contraste)
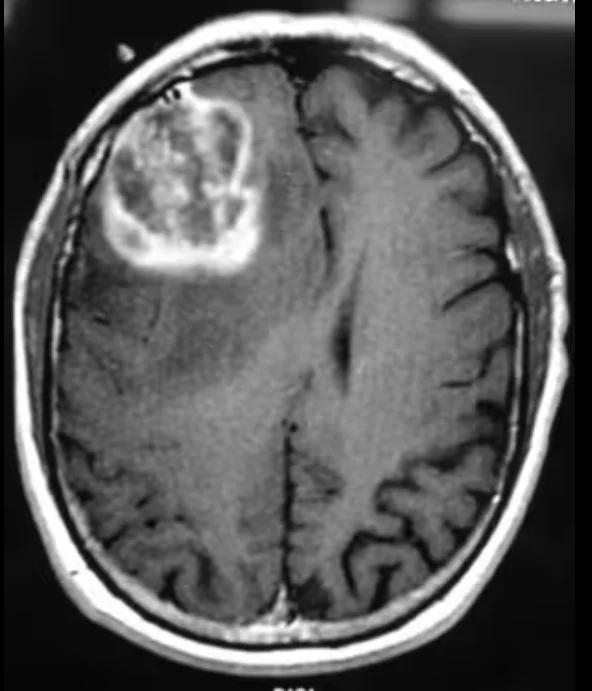
Le parcours diagnostique commence généralement par une IRM avec injection de produit de contraste, qui fournit des images détaillées du cerveau et aide les médecins à évaluer la taille, la localisation et le comportement de la tumeur.
- Le glioblastome se présente souvent comme une masse irrégulière et d'aspect agressif. Il montre typiquement une prise de contraste hétérogène, un œdème cérébral important et des zones centrales sombres correspondant à des tissus nécrosés. Ces caractéristiques suggèrent une croissance rapide et une infiltration des tissus cérébraux adjacents.
- Les gliomes de bas grade, en revanche, présentent généralement un aspect plus uniforme et mieux délimité. Ils ont tendance à croître plus lentement, à provoquer moins d'œdème et sont souvent dépourvus de zones de nécrose tissulaire. Certains peuvent même ne pas se rehausser significativement après injection de produit de contraste.
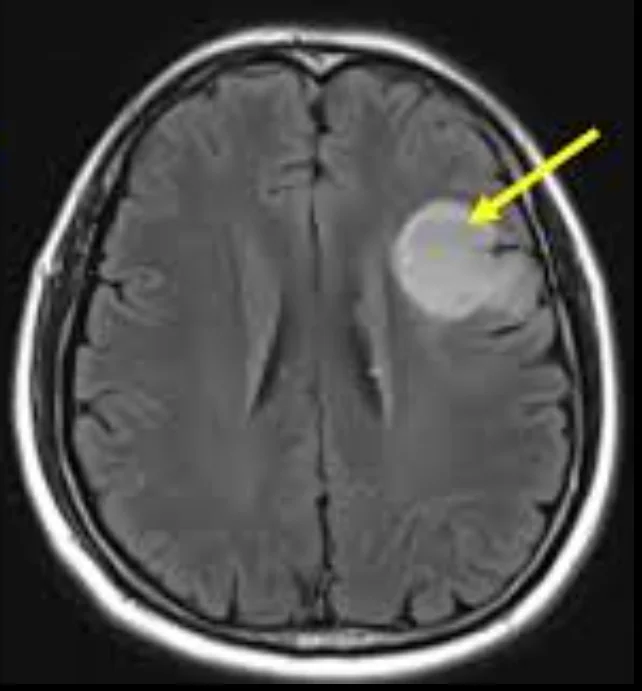
Bien que l'IRM fournisse des indications importantes, l'imagerie seule ne permet pas de confirmer le type ou le grade exact de la tumeur.
2. Biopsie ou examen chirurgical des tissus
Pour établir un diagnostic définitif, les médecins doivent examiner le tissu tumoral lui-même.
- Cela se fait soit par une biopsie stéréotaxique (une procédure minimalement invasive), soit lors de l'ablation chirurgicale de la tumeur, si la chirurgie est possible.
- Un neuropathologiste étudie le tissu au microscope pour évaluer l'apparence des cellules, les modes de croissance et les signes d'agressivité tels que la division cellulaire rapide ou la nécrose.
Cette étape est essentielle pour déterminer si la tumeur est un gliome de bas grade ou un glioblastome de grade 4, qui est la forme la plus agressive de gliome.
3. Tests moléculaires et génétiques
Le diagnostic moderne des tumeurs cérébrales ne se limite plus à l'observation au microscope. Les médecins effectuent désormais des tests moléculaires sur le tissu tumoral afin de mieux caractériser la maladie et de personnaliser le traitement.
Les principaux marqueurs comprennent :
- Statut mutationnel IDH : Les tumeurs porteuses d’une mutation IDH se développent généralement plus lentement et sont associées à un meilleur pronostic. Les glioblastomes sont souvent de type sauvage IDH, c’est-à-dire qu’ils ne présentent pas cette mutation.
- Méthylation du promoteur MGMT : ce marqueur permet de prédire la réponse tumorale à la chimiothérapie, notamment au témozolomide. Les patients présentant des tumeurs avec méthylation du gène MGMT répondent souvent mieux au traitement.
Ces caractéristiques moléculaires confirment non seulement le diagnostic, mais jouent également un rôle majeur dans le choix des options de traitement et l'estimation des résultats.
Obtenez un devis gratuit
Pourquoi un diagnostic précis est important
Comprendre si une tumeur est un gliome ou un glioblastome aide les médecins à : choisir le plan de traitement le plus efficace ; estimer le pronostic avec plus de précision ; éviter le surtraitement ou le sous-traitement ; guider les patients et leurs familles avec des attentes plus claires. Un diagnostic précis garantit que chaque patient reçoit des soins adaptés à la biologie de la tumeur, et pas seulement à son apparence.
Traitement du gliome
Le traitement du gliome est guidé par le grade de la tumeur, son profil moléculaire, sa taille, sa localisation et l'état de santé général du patient. Compte tenu de la grande variabilité du comportement des gliomes, les plans de traitement sont individualisés et non uniformes.
Chirugie
L'exérèse chirurgicale maximale, pratiquée en toute sécurité, constitue généralement la première étape du traitement lorsque cela est possible. L'objectif est d'enlever la plus grande partie possible de la tumeur sans endommager les zones cérébrales critiques.
- La chirurgie est plus efficace dans les gliomes de bas grade, où les tumeurs sont plus localisées.
- L'ablation du tissu tumoral réduit la pression intracrânienne.
- De nombreux patients constatent une amélioration de leurs symptômes, tels que les maux de tête ou la faiblesse, après l'intervention chirurgicale.
Radiothérapie
La radiothérapie est utilisée pour détruire les cellules tumorales restantes après une intervention chirurgicale ou lorsque celle-ci n'est pas entièrement possible. La radiothérapie est généralement recommandée dans les cas suivants :
- La tumeur est de grade 3 ou plus
- Une tumeur résiduelle persiste après l'intervention chirurgicale.
- La tumeur présente des signes de progression.
Chimiothérapie
La chimiothérapie est souvent associée à la radiothérapie ou utilisée seule selon le type et le grade de la tumeur. Les approches chimiothérapeutiques courantes comprennent :
- Le témozolomide, largement utilisé pour les gliomes de haut grade
- La chimiothérapie PCV (procarbazine, lomustine et vincristine) est particulièrement efficace dans certains oligodendrogliomes.
Dans certains cas, les gliomes de bas grade présentant des caractéristiques favorables peuvent être étroitement surveillés par imagerie régulière avant de commencer la radiothérapie ou la chimiothérapie, permettant ainsi aux patients de retarder les effets secondaires liés au traitement tout en maintenant le contrôle de la maladie.
Traitement du glioblastome
La prise en charge du glioblastome est urgente et hautement coordonnée, car cette tumeur se développe rapidement et a tendance à envahir les tissus cérébraux environnants. Elle est assurée par une équipe médicale multidisciplinaire, comprenant généralement des neurochirurgiens, des radio-oncologues, des oncologues médicaux, des neurologues, des spécialistes en réadaptation et des professionnels des soins palliatifs. Le glioblastome ne pouvant être guéri par un traitement unique, la prise en charge repose sur une approche combinée et progressive visant à contrôler la croissance tumorale, à soulager les symptômes et à préserver la qualité de vie le plus longtemps possible.
1. Ablation chirurgicale maximale en toute sécurité
Le traitement commence généralement par une intervention chirurgicale maximale sans risque, ce qui signifie que les chirurgiens retirent autant de la tumeur que possible tout en protégeant les fonctions cérébrales essentielles telles que la parole, le mouvement, la vision et la mémoire.
La chirurgie permet de :
- Réduire la pression à l'intérieur du cerveau
- Améliorer les symptômes neurologiques tels que les maux de tête, les crises d'épilepsie ou la faiblesse
- Fournir des tissus pour un diagnostic précis et des tests moléculaires
- Améliorer l'efficacité des traitements de suivi
- Les cellules du glioblastome infiltrant souvent les tissus cérébraux normaux, leur ablation complète est rarement possible.
Même après une intervention chirurgicale lourde, des cellules tumorales microscopiques persistent presque toujours.
2. Radiothérapie avec chimiothérapie concomitante
Après l'intervention chirurgicale, la plupart des patients reçoivent une radiothérapie associée à une chimiothérapie, généralement débutant quelques semaines plus tard.
- La radiothérapie cible la tumeur et les zones environnantes où des cellules cancéreuses microscopiques peuvent être présentes. Elle est généralement administrée cinq jours par semaine pendant environ six semaines.
- La chimiothérapie (le plus souvent du témozolomide par voie orale) est administrée en parallèle de la radiothérapie afin de rendre les cellules cancéreuses plus sensibles aux dommages causés par les radiations.
Cette approche combinée est considérée comme le traitement de référence et améliore significativement la survie par rapport à la radiothérapie seule.
3. Chimiothérapie d'entretien (adjuvante)
Une fois la radiothérapie terminée, les patients poursuivent généralement par une chimiothérapie d'entretien.
- Le témozolomide est pris par cycles sur plusieurs mois.
- L'objectif est de ralentir la repousse tumorale et de prolonger le contrôle de la maladie
- La tolérance et la réponse sont étroitement surveillées par des examens réguliers et des analyses de sang.
La durée du traitement d'entretien dépend de la réponse du patient, de son état de santé général et du profil des effets secondaires.
4. Options de traitement supplémentaires et avancées
Chez certains patients, des traitements complémentaires peuvent être recommandés :
- Champs de traitement tumoral (TTF) : Dispositif portable qui délivre des champs électriques de faible intensité pour perturber la division des cellules cancéreuses. Son utilisation régulière en complément d’une chimiothérapie pourrait contribuer à prolonger la survie.
- Essais cliniques : Les patients peuvent être admissibles à des essais portant sur des thérapies ciblées, l’immunothérapie, les vaccins ou de nouvelles combinaisons de médicaments.
Ces essais offrent un accès à des traitements émergents qui ne sont pas encore largement disponibles. L'admissibilité dépend de la biologie de la tumeur, des traitements antérieurs et de l'état de santé général.
5. Soins de soutien, réadaptation et gestion des symptômes
Les soins de soutien constituent une partie essentielle du traitement du glioblastome et se poursuivent tout au long de l'évolution de la maladie.
Cela peut inclure:
- Médicaments contre les crises d'épilepsie, l'œdème cérébral, la douleur ou la fatigue
- Physiothérapie, ergothérapie et orthophonie pour retrouver la fonction
- Soutien nutritionnel et conseil psychologique
- Soins palliatifs pour améliorer le confort, l'autonomie et le bien-être émotionnel
L'intégration précoce des soins de soutien aide les patients à maintenir une meilleure qualité de vie pendant un traitement intensif.
Taux de survie dans le gliome par rapport au glioblastome : que montrent les études ?
En ce qui concerne la survie au glioblastome, les recherches cliniques montrent systématiquement que les résultats restent médiocres malgré les traitements actuels, même si de modestes améliorations ont été constatées au fil du temps.
Selon PubMLa survie globale médiane des adultes atteints d'un glioblastome nouvellement diagnostiqué est généralement de 12 à 15 mois, même après une chirurgie maximale suivie d'une radiothérapie et d'une chimiothérapie. Ces données sont corroborées par des revues systématiques et de vastes études institutionnelles démontrant que le traitement standard combiné améliore la survie par rapport à la radiothérapie seule.
Une analyse systématique des résultats du glioblastome a rapporté une survie globale médiane d'environ 13.5 mois, avec des taux de survie à cinq ans généralement inférieurs à 6 %. PubMed L'étude a rapporté des résultats allant d'une survie médiane de 9 à 14 mois, en fonction de l'intensité du traitement et des facteurs liés au patient.
Le taux de survie varie considérablement en fonction de plusieurs facteurs clés :
- Étendue de la résection chirurgicale : Les patients qui subissent une ablation tumorale plus complète ont tendance à vivre plus longtemps que ceux qui subissent seulement une biopsie.
- Marqueurs moléculaires : Les tumeurs présentant une méthylation du promoteur MGMT et des mutations IDH sont associées à une survie plus longue que les tumeurs ne présentant pas ces marqueurs.
- Âge et état de santé général : Les patients plus jeunes obtiennent souvent de meilleurs résultats que les patients plus âgés.
Même avec un traitement optimal, la survie à long terme est rare. Les taux de survie à cinq ans dans les populations actuelles sont généralement faibles, souvent inférieurs à 10 %, ce qui reflète l'agressivité du glioblastome. Certaines revues systématiques plus anciennes suggèrent une survie à cinq ans d'environ 4 % dans de nombreuses cohortes, et moins de 1 % survivent dix ans ou plus.
En revanche, les gliomes de bas grade (grades 2 et 3) présentent généralement une survie beaucoup plus longue, souvent de plusieurs années voire de plusieurs décennies chez de nombreux patients, notamment lorsque les caractéristiques moléculaires et la réponse au traitement sont favorables. Globalement, bien que la survie médiane pour le glioblastome se situe autour de 12 à 15 mois, les résultats individuels varient considérablement en fonction de facteurs biologiques, cliniques et liés au traitement.
Pourquoi le glioblastome récidive-t-il fréquemment ?
Malgré des traitements agressifs incluant chirurgie, radiothérapie et chimiothérapie, la récidive du glioblastome est fréquente et souvent inévitable. La plupart des patients présentent une repousse tumorale, même lorsque le traitement respecte les meilleures pratiques. L'une des principales raisons est la propagation microscopique des tumeurs au-delà des marges visibles. Les cellules du glioblastome infiltrent les tissus cérébraux environnants à un niveau microscopique, s'étendant bien au-delà de ce qui est visible sur les IRM ou retiré lors de l'intervention chirurgicale. De ce fait, des cellules cancéreuses persistent souvent, même après une résection maximale. La résistance à la chimiothérapie est un autre facteur contribuant à ces récidives.
Les cellules du glioblastome peuvent s'adapter et développer une résistance à des médicaments comme le témozolomide, ce qui réduit l'efficacité du traitement à long terme. Certaines cellules tumorales survivent au traitement initial et entraînent ultérieurement une récidive tumorale. La faible pénétration des médicaments à travers la barrière hémato-encéphalique joue également un rôle important. Cette barrière protège le cerveau des substances nocives, mais empêche aussi de nombreux agents chimiothérapeutiques d'atteindre les cellules tumorales à des concentrations suffisantes, limitant ainsi l'efficacité du traitement.
En raison de ces facteurs, la plupart des récidives de glioblastome surviennent dans l'année suivant le traitement initial. La récidive est généralement plus difficile à traiter et nécessite souvent des thérapies complémentaires, des essais cliniques ou des soins de support.
Différences entre les gliomes et les glioblastomes chez l'enfant et l'adulte
- Comportement tumoral : Chez l'enfant, les gliomes diffèrent souvent de ceux de l'adulte. Certains gliomes pédiatriques évoluent plus lentement et répondent mieux au traitement, tandis que d'autres peuvent rester agressifs. L'adulte est plus susceptible de développer un glioblastome, une tumeur agressive à croissance rapide.
- Tolérance au traitement : Le corps et le cerveau des enfants étant encore en développement, leur réaction à la chirurgie, à la chimiothérapie ou à la radiothérapie peut varier. Les médecins veillent à trouver un juste équilibre entre l'efficacité du traitement et la minimisation des effets secondaires à long terme sur la croissance et le développement cérébral. Chez l'adulte, les traitements agressifs peuvent entraîner davantage d'effets secondaires et la convalescence peut être plus longue.
- Symptômes et dépistage : Chez l'enfant, des symptômes tels que des changements dans les résultats scolaires, le comportement ou la coordination peuvent apparaître en premier, parfois avant même les signes physiques évidents. Chez l'adulte, on observe souvent des maux de tête, des troubles de la mémoire ou une faiblesse dans un membre.
- Considérations à long terme : Les patients pédiatriques peuvent nécessiter un suivi régulier de leurs apprentissages, de leur développement et de leurs fonctions cognitives après le traitement. Les adultes peuvent rencontrer des difficultés à reprendre le travail ou à gérer leurs responsabilités quotidiennes et ont besoin d'un soutien pour leur santé mentale et leur qualité de vie.
Qualité de vie et soins de soutien
Les soins de soutien aux patients atteints de gliome ou de glioblastome ne se limitent pas au traitement de la tumeur elle-même ; leur objectif principal est de les aider à maintenir un confort optimal, leur autonomie et leur participation à la vie quotidienne. La gestion des symptômes est primordiale, avec des médicaments adaptés pour contrôler les maux de tête, les crises d’épilepsie, les nausées, la fatigue et autres effets secondaires, tandis que la prise en charge de la douleur est personnalisée. Les services de réadaptation, tels que la kinésithérapie, l’ergothérapie et l’orthophonie, contribuent au maintien de la force, de la mobilité, des capacités fonctionnelles et de la communication.
Le soutien émotionnel et social est tout aussi important ; les consultations psychologiques, les groupes de soutien et l’accompagnement des familles aident les patients à gérer le stress, l’anxiété ou la dépression. Les enfants peuvent avoir besoin d’un soutien supplémentaire pour leurs études, leurs compétences sociales et leur développement émotionnel, tandis que les adultes peuvent avoir besoin d’aide pour concilier travail, responsabilités familiales et maintien de leur autonomie.
Les approches holistiques, incluant la nutrition, l'exercice physique doux et les techniques de relaxation, sont encouragées pour améliorer le bien-être général. Les soins palliatifs peuvent également être mis en place précocement afin d'améliorer le confort, de préserver la dignité et d'accompagner les patients et leurs familles tout au long du parcours de soins.
Lisez aussi: Coût du traitement des tumeurs cérébrales en Inde
Perspective clinique
D'un point de vue médical, le glioblastome n'est pas simplement une forme plus grave de gliome ; c'est une maladie différente et plus agressive, présentant un comportement et des défis thérapeutiques spécifiques. Contrairement aux gliomes de bas grade, les glioblastomes se développent plus rapidement, affectent le cerveau plus sévèrement et sont plus difficiles à traiter. Un diagnostic précoce grâce à des tests moléculaires (qui analysent le patrimoine génétique de la tumeur) est essentiel car il permet aux médecins de choisir les traitements les plus efficaces pour chaque patient.
La prise en charge de ces patients fait généralement intervenir une équipe de spécialistes, notamment des neurochirurgiens, des oncologues, des radiothérapeutes, des infirmières et des thérapeutes. Grâce à cette collaboration, les médecins peuvent améliorer les symptômes, ralentir la croissance tumorale et favoriser une meilleure qualité de vie pour les patients atteints de gliome et de glioblastome.
Conclusion : Gliome vs Glioblastome
Le gliome est une vaste catégorie de tumeurs cérébrales dont le comportement peut varier considérablement selon leur type et leur grade. Certains gliomes se développent lentement et répondent bien au traitement, tandis que d'autres sont plus agressifs. Le glioblastome, quant à lui, est la forme la plus agressive de gliome. Il se développe rapidement, récidive souvent après le traitement et son pronostic est généralement plus sombre. Il est essentiel de bien distinguer le gliome du glioblastome. Cela permet aux médecins de choisir les traitements les plus appropriés, aide les patients et leurs familles à comprendre ce à quoi ils peuvent s'attendre et permet aux soignants de planifier efficacement les soins de soutien.
En comprenant ces différences, les patients, leurs familles et les équipes soignantes peuvent prendre des décisions éclairées, se préparer aux difficultés et aborder le traitement avec des attentes réalistes. Cette clarté favorise non seulement de meilleurs résultats médicaux, mais contribue également à préserver la qualité de vie et le bien-être émotionnel tout au long du parcours de soins.
Lire d'autres articles de blog connexes
Références
Questions fréquentes
Le terme « gliome » désigne de manière générale les tumeurs cérébrales qui se développent à partir des cellules gliales, lesquelles soutiennent et protègent les cellules nerveuses. Les gliomes peuvent être à croissance lente ou rapide, et leur grade varie de bas grade à haut grade.
Le glioblastome (GBM) est le type de gliome le plus agressif et de plus haut grade (grade IV). Il se développe rapidement, infiltre les tissus cérébraux environnants et nécessite un traitement intensif.
Oui. Le glioblastome est un type de gliome, mais tous les gliomes ne sont pas des glioblastomes.
Oui. Certains gliomes de bas ou de grade intermédiaire peuvent se transformer en glioblastome au fil du temps, surtout s'ils ne sont pas traités ou s'ils sont génétiquement agressifs.
Le glioblastome n'est actuellement pas considéré comme guérissable, mais le traitement peut : prolonger la survie, réduire les symptômes et améliorer la qualité de vie.
Le glioblastome se développe rapidement et peut progresser en quelques semaines ou quelques mois, c'est pourquoi un traitement rapide est essentiel.
La survie est variable, mais grâce au traitement, de nombreux patients vivent 12 à 18 mois, voire plus, en fonction de leur âge, de leur état de santé et de la biologie de leur tumeur.
Si la chirurgie n'est pas possible, la radiothérapie et la chimiothérapie sont utilisées pour contrôler la croissance tumorale et gérer les symptômes.
Des marqueurs comme la mutation IDH et la méthylation MGMT aident à orienter les décisions thérapeutiques et à prédire la réponse au traitement.
La plupart des cas ne sont pas héréditaires. Le glioblastome survient généralement de façon sporadique, sans antécédents familiaux.
Sanjana
Auteur
Sanjana Sharma est une éducatrice certifiée en diabète possédant une solide formation universitaire en nutrition et diététique. Elle est titulaire d'une licence en nutrition clinique et diététique, d'un master en alimentation et nutrition de l'Université CCS, d'un diplôme en santé et éducation de l'IGNOU et d'une certification du NDEP. Dévouée à aider les patients à gérer leur santé grâce à des soins et une éducation personnalisés, elle met son expertise et sa compassion au service de son travail. Outre ses activités de conseil et d'écriture, Sanjana aime se tenir au courant des tendances mode, partager des mèmes d'entreprise sur Instagram et, bien sûr, réfléchir à l'alimentation.
Dr. Prof. Manmohan S
Critique
Le Dr Manmohan Singh est neurochirurgien de renom et vice-président du département de neurosciences chez Paras Health, à Gurugram. Fort de plus de 25 ans d'expérience, il est spécialisé dans les interventions complexes du cerveau et de la colonne vertébrale, les interventions de la base du crâne et les soins neurochirurgicaux de pointe. Il a précédemment occupé le poste de professeur de neurochirurgie et de directeur du centre Gamma Knife à l'AIIMS de New Delhi. Il est reconnu pour son excellence clinique et son approche centrée sur le patient.